Bulletin de pratique en matière de WHEC et
directives cliniques de gestion pour des fournisseurs de soins de santé.
La concession éducative a fourni par Health de Women’s et
centre d’éducation (WHEC).
La cystite interstitielle (IC) est une maladie de la
vessie caractérisée par la fréquence et l’urgence urinaire, vider
irritable, et la douleur pelvienne. Elle est une chronique,
débilitant le syndrome qui se produit principalement chez les
femmes et présente souvent avec des symptômes urologic et
gynécologiques. Le but de ce document est d’enrichir
l’arrangement de cette condition parmi les gynécologues et les
médecins primaires de soin, à qui beaucoup de patients présentant
de douleur le présent pelvien chronique non identifié au
commencement. Les chercheurs ont récemment développé
plusieurs outils pour aider des cliniciens à faire le diagnostic tôt
et à offrir le traitement efficace. Puisque cette condition
tend à se développer très lentement, les patients peuvent même ne
pas pouvoir expliquer quand elle a commencé. D’ailleurs, les
symptômes se produisent sur un continuum et peuvent évaser avec des
rapports, des allergies, la menstruation, ou l’effort sexuelle.
Quinze pour cent de femmes aux Etats-Unis
(approximativement 9 à 15 millions) ont consulté leurs gynécologues
pour le traitement de la douleur pelvienne chronique (1). Dans
approximativement un tiers de ces caisses, une tentative a été faite
de traiter le problème en l’absence d’étiologie claire une pratique
qui alimente typiquement, plutôt qu’arrête le cycle de ces troubles.
La prédominance de la cystite interstitielle est beaucoup plus
élevée que ce qui est actuellement estimé dans la littérature.
Les individus avec douleur pelvienne chronique d’origine de
vessie ont la cystite interstitielle, des troubles qui peuvent causer
urgency/frequency et/ou dysparunia urinaire et/ou douleur
intermittente ou persistante dans tout nombre et combinaison des
emplacements pelviens. Ses effets psychologiques peuvent être
également profonds ; en effet, ces troubles sont connus pour
causer la dépression et l’isolement social. Comme les
cliniciens avec la responsabilité de traiter la douleur du patient,
nous doivent considérer son diagnostic chez les femmes avec douleur
pelvienne chronique.
Le but de ce document est d’améliorer la connaissance
nécessaire des fournisseurs de soins de santé pour faire le diagnostic
correct et tôt de la cystite interstitielle (IC). En outre,
même pour les cliniciens qui se rendent compte de la cystite
interstitielle (IC), de quelques patients avec des symptômes
atypiques ou des conditions Co-morbides qui rendent le diagnostic
correct provocant. Il est également important de noter que,
tandis que l’IC peut présenter comme urgence et fréquence sans
douleur, la présence de la douleur est exigée pour le diagnostic.
Cette revue récapitule des discussions des issues identifiées
en tant qu’étant concernées en plusieurs aperçus, entrevues, et
sessions question-réponse aux activités éducatives
professionnelles.
Neuro–pathologie de la cystite interstitielle (IC)
:
On pense l’IC pour être dérivé d’un défaut dans la
couche glycosaminoglycan protectrice (de BÂILLON) de la vessie
muqueuse et par un plus grand nombre de cellules activées de mât de
vessie (2). La cystite interstitielle n’est pas une maladie
d’organe d’extrémité, mais un syndrome viscéral de douleur.
Les syndromes viscéraux de douleur comportent l’inflammation
neurogène chronique, l’activité finie d’afférent primaire, et la
sensibilisation centrale, que tous agissent l’un sur l’autre pour
perpétuer la douleur. Pour l’inconnu de raison, la couche
protectrice de BÂILLON de la vessie est dénudée dans l’IC,
permettant à des corps dissous tels que le potassium de filtrer à
travers l’uro-épithélium habituellement imperméable. Le
résultat est douleur de l’excitation de nerf-fin et finalement,
dégagement de cellules de mât. Degranulation des cellules
de mât peut se produire en raison de et réaction IgE-négociée
d’hypersensibilité. Ceci mène à un dégagement de
l’histamine, qui cause la douleur et l’irritation localisées dans le
tissu.
Les patients présentant l’IC tendent également à
éprouver les conditions qui sont aggravées par effort, tel que des
allergies, syndrome irritable d’entrailles, et migraines. Le
dégagement des neuropeptides pendant l’effort peut mener à la
sécrétion locale de cellules de mât de vessie de vasoactif,
pro-inflammatoire, et la substance nocive P. Sympathetic de
médiateurs et les nerfs parasympathiques fusionnent dans le
ganglia pelvien. Les neurones parasympathiques peuvent porter
les stimulus nocifs de la vessie passant par les segments S 2, 3, et 4
du cordon médullaire, qui est le même endroit de l’innervation
sensorielle au secteur perineal. Les nerfs afférents
viscéraux peuvent s’embrancher dans le cordon médullaire à la
synapse avec beaucoup de cellules dorsales de klaxon dans beaucoup de
segments de cordon médullaire. En outre, les nerfs des organes
multiples (par exemple, muscle, viscères, peau) peuvent converger sur
un neurone dorsal simple de klaxon et s’affecter, non seulement à ce
niveau du klaxon dorsal, mais également aux niveaux de supraspinal
comme neurones de second ordre voyagent dans la proximité étroite
sur le chemin au cortex cérébral. Ce qui mélange est
important pour permettre aux organes de communiquer pour des fonctions
normales et coordonnées de corps. Cependant, puisque les
neurones dorsaux de klaxon sont le coeur du système de communication,
quelque chose qui affecte leur fonction peut avoir des effets
répandus (3).
Butrick DANS LE SENS DES AIGUILLES D’UNE MONTRE.
Douleur Pelvienne : Diagnostic et gestion.
Howard F, rédacteur. Lippincott;2000:279-299.
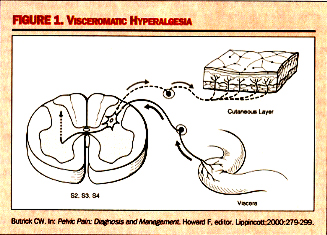
Hyperalgesia de Viscerovisceral : C’est un phénomène dans lequel la douleur d’un organe
peut induire la douleur et le dysfonctionnement dans des autres.
Dans ce réflexe hyperalgesic, un organe est l’organe
original qui est enflamé, comme la vessie. Comme réflexe de
hyperalgesia, un autre organe dont les afférents viscéraux sont
partage le même niveau dermatomal deviendra hypersensible en même
temps. Ce développement d’un état hyperalgesic viscéral
secondaire est simplement un signe davantage de de dysregulation du
klaxon dorsal et de fonction de traitement sensorielle à ce niveau.
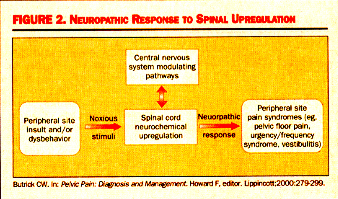
Tandis que l’arrangement du neuropathology des syndromes
viscéraux de douleur tels que l’IC devient cristallisé, les
cliniciens luttent toujours avec la question de base de pourquoi
quelques patients développent le problème de l’upregulated le
klaxon dorsal et d’autres pas . Ceci est généralement pensée
pour être l’interaction entre la quantité de stimulus-les deux
nocifs durée et sévérité, aussi bien que la capacité pour les
influences suprasacral, ou des voies de modulation de haut en bas,
de contrôler les changements biochimiques se produisant dans le
klaxon dorsal.
Diagnostic :
Les symptômes de l’IC, de l’urgence et de la douleur,
tendent à être cycliques et sont les cachets de la maladie.
L’insulte de vessie mène aux dommages épithéliaux de couche
et la fuite résultante du potassium dans l’interstitium, suivie de
l’activation des deux fibres sensorielles parasympathiques
(responsables de l’urgence) et C-fibres (fibres conduisant des
impulsions de nerf) et le dégagement de la substance P (un
polypeptide qui transmet des impulsions de douleur). Les
symptômes de douleur de l’IC sont :
- Symptômes de Gyneurologic : Dysparunia,
fusée Prémenstruelle, fusée après sexe, vidant des symptômes, et la
douleur dans l’abdomen inférieur – vulva, urètre, vagin, cuisses
médiales, perineum. - Symptômes gynécologiques de douleur pelvienne :
Fusée de Dysparunia, de Menstrual/prémenstruel, fusées après
sexe, douleur dans l’abdomen inférieur et Dysmenorrhea.
Les femmes avec l’IC s’habituent à la fréquence et
l’urgence urinaire, l’irritation vaginale, et la douleur pelvienne
chronique qui accompagnent typiquement cette condition.
L’identification quand les fusées d’un patient se produisent
peut fournir la clef à la cause d’arrangement, et donc à son
traitement réussi. Si les symptômes évasent pendant ou après
sexe, premenstrually, pendant la saison d’allergie, et/ou en
période d’émotif et effort physique, alors la probabilité d’un
diagnostic d’IC est sensiblement augmentée. La possibilité
que le patient a l’IC devrait être considérée dans les affaires
suivantes (4).
- Le patient a un diagnostic d’UTI récurrent ;
- Un diagnostic de syndrome uréthral a été donné ;
- Il y a un diagnostic d’une vessie trop active, sec, avec
ou sans la douleur ; - Il y a un diagnostic d’endométriose réfractaire, de
vestibulitis vulvar, de vaginitis de levure, ou de douleur
pelvienne juste. - Examen physique – vessie tendre et alarme de questionnaire
de PUF > 8 et analyse d’urine négative.
Balance patiente de symptômes de PUF
Test de Sensibilité De Potassium (PST) :
Les PST, également connus sous le nom de test de KCL
ou pasteurs examinent, impliquent d’inculquer une solution de
chlorure de potassium dans la vessie par l’intermédiaire du cathéter
urinaire. Le test de sensibilité de potassium est employé
principalement pour diagnostiquer l’IC, particulièrement quand
l’origine des symptômes n’est pas claire. Il mesure la
perméabilité épithéliale sur la base de patient et peut être
exécuté par n’importe quel fournisseur, praticienne d’infirmière,
aide de médecin, ou médecin primaire de soin. Les patients
avec une vessie normale typiquement n’absorbent pas ou ne réagissent
pas avec pain/urgency au chlorure de potassium (KCL).
Cependant, le potassium dans des la plupart des vessies d’IC
stimule les nerfs perivesical et cause le malaise et l’inflammation
significatifs dans le mur de vessie. Le PST évalue la
réponse d’un patient à la présence du potassium dans la vessie.
La majorité de patients (> 70%) présentant l’IC ont PST
positif et PST positif n’est pas suffisant pour diagnostiquer d’une
manière concluante l’IC.
Procédé : Ayez le patient vide avant
d’examiner. Préparez les solutions de test et de délivrance.
Marquez les seringues. L’endroit drapent sous le patient
et le secteur de préparation avec la tige de Betadine.
Insérez le cathéter avec la seringue stérile de solution de
water/saline jointe. Instillez lentement les 40 cc de la
solution stérile de water/saline et laissez le cathéter et la
seringue en place ; attendez 5 minutes. Demandez à
patient si la solution provoquait n’importe quel changement d’urgence
et/ou de malaise et évalue le changement sur une échelle de 0 à 5.
Retirez la solution avec la seringue et enlevez la seringue,
laissant toujours le cathéter dans la vessie. Attachez
maintenant la solution de KCL (40 meq dans les sacs de mL)syringe
100 au cathéter. Instillez lentement les 40 cc de la solution
de KCL et les observez pour la réaction patiente.
Si le patient réagit – ARRÊT ! ! Le test est
positif. Arrêtez l’instillation et évaluez le changement de
l’urgence et/ou de la douleur sur une échelle de 0 à 5 exprimés par
le patient. Éliminez n’importe quelle solution
inculquée, la rincez avec 60 ml de l’eau, et enlevez la
seringue, laissant le cathéter en place. Instillez la solution
de délivrance (héparine 40.000 unités + 8 cc de 1% de chlorhydrate
de lidocaïne + 3 cc 8.4% de bicarbonate de soude ; apportez le
volume total de 20 cc avec la solution stérile de water/saline)
immédiatement avec la seringue. Enlevez le cathéter et la
seringue (ensemble) de la vessie et demandez au patient de tenir la
solution de délivrance pendant 15 à 20 minutes. Ayez le
patient vide hors de la solution de délivrance et le test est
accompli.
Si le patient ne réagit pas – laissez le cathéter et la
seringue en place et attendez 5 minutes. Demandez maintenant à
patient si la solution de KCL causait n’importe quel changement
d’urgence et/ou de douleur et évalue le changement sur la feuille de
reportage. S’il n’y a aucune différence remarquable entre la
solution stérile de water/saline et la solution de KCL après 5
minutes, laissez la solution de KCL dans la vessie et enlevez le
cathéter et le patient drape. Ayez le patient vide hors de la
solution. Évaluez n’importe quel malaise perçu après avoir
vidé et le test est complet. Marquage de PST :
PST négatif – aucune différence remarquable entre les
solutions.
PST positif – évaluation de 2 ou plus dans la pièce de
solution de KCL du test pour l’urgence ou la douleur.
Différence remarquable entre 2 solutions.
D’autres tests facultatifs qui pourraient être dignes de
la considération diagnostique incluent ce qui suit :
- Ultrasons pelviens ou de transvaginal
- Évaluation résiduelle de volume d’urine de
Postvoid (PVR) - Pyelogram intraveineux pour éliminer la
présence des pierres dans l’uretère. La pathologie abdominale,
ou l’évaluation des uretères, peut être faite par l’intermédiaire
d’un balayage tomographique calculé. Si vidant le
dysfonctionnement est suspecté, l’on a pourrait considérer exécuter
l’évaluation d’Urodynamic. - Cystoscopy : avec le hydrodistension sous
l’anesthésie est de grande utilité en aidant à confirmer un
diagnostic d’IC et est généralement réservé pour l’étape grave
de la maladie. Le cystoscopy tient compte d’une inspection
magnifiée de la vessie et de l’urètre pour éliminer toutes les
anomalies, et permet la biopsie (si nécessaire). Une petite
capacité de vessie sous l’anesthésie soutient un diagnostic d’ICet est inversement proportionnée à la présence de la pièce
rapportée du chasseur (5). En plus de est de service comme
outil diagnostique, le cystoscopy avec le hydrodistension a
été montré pour améliorer des symptômes d’IC dans 30% à 60%
de patients dans un délai de 2 à 4 semaines (après une première
période l’où les symptômes empirent), et est donc employé comme
première option thérapeutique. - Tests d’évolution : deux marqueurs cliniques de
promesse à l’étude incluent GP51, une glycoprotéine urinaire
normalement trouvée dans la doublure de mucine de l’appareil
urinaire ; et facteur antiproliferative (APF). Les
patients présentant l’IC ont des niveaux plus bas de GP51 que
contrôlent ; plus loin plus, les niveaux plus bas semblent
être uniques aux patients présentant l’IC. Le facteurantiproliferative (APF) empêche la prolifération des cellules
épithéliales et du complexe de vessie change dans les niveaux
épithéliaux de facteur de croissance (6).
Gestion :
La clef au traitement réussi de l’IC est thérapie
multimodal. Les patients présentant la maladie légère
peuvent faire bien avec la thérapie de mono-drogue, tandis que ces
approche multimodal pour contrôler tous leurs symptômes.
Ces médicaments seraient ceux qui corrigent le
dysfonctionnement épithélial, les agents demodulation, ou les
agents qui contrôlent des allergies.
Commande de symptôme par le régime –
dans l’IC, les nourritures qui sont élevées en potassium tendent
à provoquer des symptômes. Les substances de nourriture
mentionnées le plus généralement dans les plaintes des patients
sont des agrumes, des tomates, un chocolat, et un café, qui sont
riches en potassium ; les auteurs recommandent d’éviter ces
nourritures pour les patients présentant l’IC. Comme mesure
pratique, les nourritures mentionnées sont les primaires ont
recommandé que les patients d’IC évitent après avoir commencé
la thérapie.
Bio-alimentez-en arrière, stimulation et EMG
électriques – quelques individus avec l’IC
peuvent tirer bénéfice de bio-alimentent-en arrière des
techniques telles que des techniques de gestion d’urgency/frequency
et des méthodes d’abaisser la tonalité musculaire de repos de
plancher pelvien. Bien élevé bio-alimentez-en arrière le
personnel et le choix patient rigoureux sont essentiel au succès de
ce mode de traitement. Des techniques cutanées périphériques
ou les implants de constante, stimulation précédée de test, peuvent
être utilisés pour affecter le neuromodulation pour le traitement
de l’IC dans les patients appropriés.
Régime oral – sodium de polysulfate
de pentosanne (PPS ; Elmiron) est la seule drogue de sa sorte
approuvée pour traiter la douleur de l’IC. Son mécanisme
d’action semble devoir aider à reconstituer au mucus (BÂILLON) de la
vessie sa fonction normale de régler la perméabilité épithéliale.
Le PPS peut avoir l’effet additionnel, par exemple, on le
connaît pour empêcher l’activité de cellules de mât. Les
auteurs recommandent le magnésium du sodium 100 de polysulfate de
pentosanne trois fois quotidiennement pour l’usage en tant que
thérapie principale pour l’IC. La durée de l’utilisation
dernier 8 mois montre le taux de réponse de 70% et plus élevé.
En outre, la résistance au PPS n’a pas été démontrée dans
les patients en utilisant cet agent chronique pendant 3 années (7).
Des patients sont recommandés pour rester sur la thérapie de
PPS pendant au moins 6 mois ; elle est bien tolérée avec des
effets secondaires légers, peu fréquents, et passagers. Dans
approximativement 1% de la fonction de foie légère de patients des
changements ont été vus ; ceux-ci n’ont pas été associés à
l’ictère ou d’autres signes ou symptômes cliniques.
Les patients ont besoin souvent de l’utilisation d’un
agent d’empêcher la douleur hyperactivité-induite neurale liée
à l’IC. Amitriptyline (Elavil) et hydroxyzine
(Atarax) sont les deux interventions le plus généralement
administrées à cette fin. Hydroxyzine (Atarax) exerce un
effet antihistaminic et est donc efficace pendant les fusées
allergiques. L’utilisation concomitante du chlorure
d’oxybutynin (Ditropan XL) de réduire l’urgence et la
fréquence est également recommandée.
Traitements d’Intravesical – elle
peut seul être employée dans les patients qui ne peuvent pas
tolérer le traitement oral ou ceux pour qui le traitement oral est
inefficace. La solution diméthylique du sulfoxyde (DMSO) est
la premiers ligne et seulement agent approuvés par la FDA (1978) pour
l’instillation de vessie. DMSO est un analgésique
anti-inflammatoire avec les propriétés dedétente qui semble
augmenter la mise à feu réflexe des axones efférents de nerf
pelvien, augmenter la capacité de vessie, libérer l’oxyde nitrique
des neurones afférents, et empêcher la sécrétion de cellules de
mât. Il est un coffre-fort et un principal modérément
efficace de la thérapie pour des patients présentant l’IC.
DMSO a un bon profil de sûreté, bien qu’il laisse a
ail-comme taste/odor sur le souffle et la peau pendant jusqu’à
72 heures après traitement.
Sodium de polysulfate de pentosanne (PPS) ou
instillation intravesical d’Elmiron – la
solution de PPS contiennent le magnésium 200 le magnésium (pour des
femmes) ou 400 (pour les hommes) mélangé à 3 cc du bicarbonate de
soude de 1% et à 8cc du lidocaïne de 1% inculqué dans
la vessie et maintenu pendant 30 minutes et alors vidé. La
thérapie d’instillation de PPS offre une nouvelle option pour les
patients d’IC qui ne peuvent pas prendre le PPS sous son forme
orale. D’autres agents intravesical utilisés sont héparine,
acide hyaluronic, Resiniferatoxin, et bacille
Calmatte-Guerin.
La chirurgie d’Exonerative –
cystectomy, accomplissent le conduit ureteroileal ou le
cystectomy, complet avec la déviation continente par n’importe
quelle technique est fait en dernier recours.
Traitement de promesse d’Intravesical pour la cystite
interstitielle :
l’administration d’Intra-vessie d’une solution
contenant le lidocaïne, le bicarbonate, et l’héparine a montré pour
améliorer des symptômes d’IC et pour réduire le dyspareunia
(8). Les résultats encouragent et soulèvent la possibilité
d’une thérapie intravesical efficace qui bien-est tolérée et
améliore le dyspareunia. L’alcalisation du lidocaïne de 5%
par amortissement avec du bicarbonate de soude 8.4% fournit
l’absorption sûre et fiable dans la vessie suivant l’administration
intravesical. L’héparine est largement répandue pour la
thérapie intravesical et contrôle efficacement des symptômes
dans approximativement 50% de patients présentant le syndrome
douloureux de vessie (PBS)/cystite interstitielle (IC).
L’efficacité d’une solution thérapeutique intravesical
contenant 40.000 unités internationales d’héparine, 8 ml de
lidocaïne de 2% (magnésium 160), et bicarbonate de soude 8.4% a
été démontrée dans 35 patients présentant l’IC nouvellement
diagnostiqué et la fréquence, l’urgence, et la douleur
significatives. Une instillation simple a produit le soulagement
immédiat des symptômes de la douleur et l’urgence dans 94% des
patients, qui ont durée pendant au moins 4 heures dans 50% de
patients a suivi par téléphone et aussi longtemps que 14 à 24
heures dans certains. Dans 20 patients qui ont reçu un autre
cours pour 2 semaines, soulagement de douleur et urgence a été
soutenu dans 80% et a duré pendant au moins 48 heures après le
dernier traitement intravesical. Le soulagement persistant
des symptômes au delà de l’effet anesthésique immédiat du
lidocaïne suggère que la solution puisse vers le bas-régler les
nerfs sensoriels de vessie et accélère le rétablissement de la
vessie (9).
Thérapie D’Interventional : le cystoscopy
avec le hydrodistention de la vessie exécuté sous l’anesthésie
générale est censé pour aider 40% à 50% de patients présentant
l’IC. De meilleurs résultats sont vus dans les patients
présentant une capacité de vessie de 150 ml ou plus grand avant
distention. Une étude rétrospective a comparé 47 patients
à l’IC qui avait subi le cystoscopy et le hydrodistention et
37 patients présentant l’IC qui n’a pas eu. Avec le patient
sous l’anesthésie générale, l’irrigation a coulé sous la pesanteur
(pression 100centimètre) jusqu’à ce qu’elle se soit arrêtée, et
le hydrodistention a été maintenu pendant 2 minutes. De la
pression de Digital a été maintenue contre l’urètre par
l’urologiste d’éviter la fuite de l’irrigant autour du
cystoscope. Après que la vessie ait été vidangée, le
hydrodistention a été répété. Les patients qui ont subi
le hydrodistention ont rapporté sensiblement plus de la douleur,
de la douleur vaginale, et du dyspareunia ou de la douleur
d’éjaculation que ceux qui n’ont pas eu le hydrodistention.
Les données de suivi pour 43 de 47 patients qui ont subi le
cystoscopy et le hydrodistention ont prouvé que 56% a rapporté
l’amélioration, qui était de courte durée (durée moyenne de 2
mois) en tout sauf 1 patient qui s’est plaint de soulagement de
symptôme durant 24 mois (10).
| Traitement de Multimodal de syndrome interstitiel de vessie de Cystitis/Painful : |
||
|---|---|---|
| Traitement | Dosage | Indication |
|
Sodium de polysulfate de pentosanne (PPS) |
tid du magnésium 100 |
Traitement de douleur lié à l’IC/ PBS |
|
Amitriptyline ou |
25 qhs de magnésium |
Inquiétude de Moderate/Severe ; |
|
Hydroxyzine et histamine |
25 qhs de magnésium ou |
La gestion des conditions allergiques a négocié |
Conclusion
La prédominance de l’IC peut être plus grande
qu’a été précédemment crue. Un diagnostic plus précis a
mené à l’amélioration des résultats de traitement et au meilleur
choix patient pour la thérapie médicale et de comportement.
Puisque les troubles peuvent co-exister, l’évaluation et la
thérapie complètes sont absolument essentielles. Le régime
oral de multi-drogue et les traitements intravesical
d’instillation décrits ci-dessus sont les modes de la thérapie
utilisés le plus souvent dans la gestion des patients présentant
l’IC. Il y a un besoin d’efforts continus d’instruire des
fournisseurs au sujet de ces conditions ainsi ils sont suffisamment
bien informés pour les diagnostiquer et traiter.
References:
- Hanno PM, Landis JR, Mathews-Cook Y, et al. Lessons learned from the National Institutes of Health interstitial cystitis database. J Urol 1999;161(2):553-557.
- Theoharides TC. The mast cells: a neuro-immuno-endocrine master player. Int J Tissue React 1996;18(1):1-21.
- Butrick CW. Underlying Neuropathology of Interstitial Cystitis. The Female Patient May 2002 Supplement issue.
- Parsons CL, Dell J, Bullen M, et al. Increased prevalence of interstitial cystitis in urologic patients and gynecologic pelvic pain patients as determined using a new symptom questionnaire. J Urol 2002;167 (4 Suppl):65.
- Nigro DA, Wein AJ, Foy M, et al. Associations among cystoscopic and urodynamic findings for women enrolled in the Interstitial Cystitis Data Base (ICDB) Study. Urology 1997;49(5A Suppl):86-92.
- Byrne DS, Sedor JF, Estojak J, et al. The urinary glycoprotien GP51 as a clinical marker for interstitial cystitis. J Urol 1999;161(6):1786-1790.
- Nickel JC, Barkin J, Forrest J, et al. Randomized, double-blinded, dose-ranging study of Pentosan polysulfate sodium for interstitial cystitis [abstract]. J Urol 2001;165(5 Suppl):67.
- Welk BK, Teichman JM. Dyspareunia response in patients with interstitial cystitis with intravesical lidocaine, bicarbonate, and heparin. Urology 2008;71:67-70
- Parson CL. Successful down-regulation of bladder sensory nerves with combination of heparin and alkalinized lidocaine in patients with interstitial cystitis. Urology 2005;65:45-48
- Ottem DP, Teichman JM. What is the value of cystoscopy with hydrodistention for interstitial cystitis? Urology 2005;66:494-499
Publié: 11 February 2009
